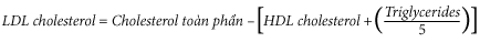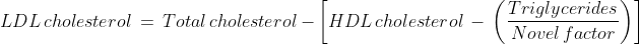Tìm hiểu phương pháp Giảm cân
Tăng lipid máu ( Rối loạn lipid máu )

Rối loạn mỡ máu là tình trạng tăng cholesterol, triglycerid (TG), hoặc cả hai trong huyết tương, hoặc nồng độ cholesterol lipoprotein mật độ cao (HDL-C) thấp góp phần vào sự phát triển của xơ vữa động mạch. Nguyên nhân có thể là tiên phát (di truyền) hoặc thứ phát. Chẩn đoán là bằng cách đo nồng độ cholesterol, TG, và các lipoprotein trong huyết tương. Điều trị bao gồm sự thay đổi chế độ ăn uống, tập thể dục, và thuốc giảm lipid.
Nồng độ lipid huyết thanh duy trì liên tục; không có ngưỡng chính xác giữa nồng độ bình thường và bất thường. Có thể tồn tại mối quan hệ tuyến tính giữa nồng độ lipid và nguy cơ tim mạch, , vì vậy nhiều người có nồng độ cholesterol “bình thường” được hưởng lợi từ việc đạt được nồng độ thấp hơn nữa. Do đó, không có định nghĩa số liệu về rối loạn lipid máu; thuật ngữ được áp dụng cho các mức nồng độ lipid mà điều trị đã được chứng minh có lợi.
Bằng chứng về lợi ích là mạnh nhất trong việc làm giảm nồng độ cao của cholesterol lipoprotein mật độ thấp (LDL-C). Trong dân số nói chung, bằng chứng ít mạnh mẽ hơn về lợi ích từ việc làm giảm nồng độ cao của TG và làm tăng nồng độ thấp của cholesterol lipoprotein tỷ trọng cao (HDL-C).
Nồng độ HDL-C không phải lúc nào cũng dự đoán nguy cơ tim mạch. Ví dụ: nồng độ HDL-C cao do một số rối loạn di truyền gây ra có thể không liên quan đến giảm nguy cơ mắc các bệnh tim mạch và nồng độ HDL-C thấp do một số rối loạn di truyền gây ra có thể không liên quan đến tăng nguy cơ mắc các bệnh tim mạch. Mặc dù nồng độ HDL-C dự đoán nguy cơ tim mạch trong dân số nói chung, nhưng nguy cơ gia tăng có thể do các yếu tố khác gây ra, chẳng hạn như các bất thường về chuyển hóa và các bất thường về lipid đi kèm, chẳng hạn như tăng triglycerid máu, chứ không phải do chính nồng độ HDL-C.
Phân loại rối loạn lipid máu
Rối loạn lipd máu được phân loại truyền thống theo mô hình của tăng lipid và lipoprotein.
Một hệ thống phân loại thực tế hơn của rối loạn lipid máu như nguyên phát hoặc thứ phát và đặc trưng của chúng như:
-
Chỉ tăng cholesterol: Tăng cholesterol máu đơn thuần hoặc đơn độc
-
Chỉ tăng TG: Tăng triglycerid máu đơn thuần hoặc đơn độc
-
Tăng cả cholesterol và TG: Tăng lipid máu hỗn hợp hoặc kết hợp
Hệ thống này không tính đến các bất thường cụ thể về lipoprotein (ví dụ: HDL-C thấp hoặc LDL-C cao) có thể góp phần gây bệnh mặc dù nồng độ cholesterol và TG bình thường.
Nguyên nhân rối loạn mỡ máu
Rối loạn mỡ máu có thể
-
Nguyên phát: Di truyền
-
Thứ phát: Nguyên nhân do lối sống và các yếu tố khác
Cả các nguyên nhân tiên phát và các nguyên nhân thứ phát góp phần gây rối loạn lipid ở nhiều mức độ khác nhau. Ví dụ, trong tăng lipid máu kết hợp tính chất gia đình, biểu hiện có thể xảy ra chỉ khi có các nguyên nhân thứ phát.
Nguyên nhân nguyên phát
Các nguyên nhân chính là do một hoặc nhiều đột biến gen dẫn đến sản xuất quá mức hoặc thanh thải kém triglycerides và LDL hoặc sản sinh ít hoặc thanh thải quá mức HDL
Nguyên nhân thứ phát
Các nguyên nhân thứ phát góp phần vào nhiều trường hợp rối loạn lipid máu ở người lớn.
Nguyên nhân thứ phát quan trọng nhất của rối loạn lipid máu ở các nước phát triển là
-
Một lối sống tĩnh tại với chế độ ăn quá nhiều tổng lượng calo, chất béo bão hòa, cholesterol và chất béo chuyển hóa
Chất béo chuyển hóa là các axit béo không no nhiều liên kết đôi hoặc không bão hòa một liên kết đôi mà các nguyên tử hydro đã được thêm vào; chúng được sử dụng trong một số thực phẩm chế biến và gây xơ vữa động mạch như chất béo no.
Các nguyên nhân thứ phát phổ biến của rối loạn lipid máu bao gồm
-
Xơ gan mật nguyên phát và các bệnh gan ứ mật khác
-
Các loại thuốc, chẳng hạn như thiazide, thuốc chẹn beta, các retinoid, thuốc kháng vi rút hoạt tính cao, cyclosporine, tacrolimus, progestin và glucocorticoid; estrogen đường uống gây ra tác dụng hỗn hợp (giảm LDL-C và tăng HDL-C, nhưng cũng làm tăng TG)
Nguyên nhân thứ phát của nồng độ HDL-C thấp bao gồm hút thuốc lá, steroid đồng hóa, nhiễm HIV và hội chứng thận hư.
Đái tháo đường là một nguyên nhân thứ phát quan trọng vì bệnh nhân có xu hướng xơ vữa động mạch kết hợp với TG cao; các phân đoạn LDL nhỏ và dày đặc; và HDL thấp (bệnh đái tháo đường rối loạn lipid máu, tăng triglycerid tăng apo B). Bệnh nhân đái tháo đường loại 2 đặc biệt có nguy cơ. Sự kết hợp này có thể là kết quả của béo phì, đái tháo đường kiểm soát kém, hoặc cả hai, có thể làm tăng các axit béo tự do trong tuần hoàn (FFAs), dẫn đến tăng sản xuất lipoprotein tỉ trọng rất thấp ở gan (VLDL). VLDL giàu TG sau đó chuyển TG và cholesterol đến LDL và HDL, thúc đẩy sự hình thành LDL nhỏ, dày đặc và thanh thải HDL giàu TG. Rối loạn lipid máu do tiểu đường thường trầm trọng hơn do tăng lượng calo nạp vào và ít hoạt động thể chất, đặc trưng cho lối sống của một số bệnh nhân tiểu đường tuýp 2. Phụ nữ đái tháo đường có nguy cơ đặc biệt với bệnh tim là kết quả của dạng rối loạn lipid máu.
Triệu chứng và Dấu hiệu của Rối loạn lipid máu
Bản thân rối loạn lipid máu thường không gây ra triệu chứng, mặc dù nồng độ TG rất cao có thể gây dị cảm, khó thở và lú lẫn. Rối loạn lipid có thể dẫn đến bệnh cơ quan đích có triệu chứng, bao gồm
-
Bệnh mạch máu (ví dụ: bệnh động mạch vành (CAD), đột quỵ và bệnh động mạch ngoại biên)
-
Viêm tụy cấp có thể do nồng độ TG cao (> 500 mg/dL [> 5,65 mmol/L])
-
Gan to, lách to có thể do nồng độ TG rất cao
Các dấu hiệu ở bệnh nhân rối loạn lipid máu nặng có thể bao gồm lắng đọng lipid cục bộ (u vàng) hoặc các dấu hiệu khác do nồng độ cao trong huyết thanh hoặc do tích tụ lipid.
Nồng độ LDL-C cao có thể gây ra u vàng gân cơ ở gân Achilles, gân khuỷu tay và gân đầu gối và trên các khớp bàn-ngón tay. Các dấu hiệu lâm sàng khác xảy ra trên bệnh nhân có LDL-C cao (ví dụ: tăng cholesterol máu có tính chất gia đình hoặc rối loạn betalipoprotein máu) bao gồm u vàng thể phẳng hoặc u vàng thể củ. Xanthomas phẳng là các mảng vữa vàng nhạt hoặc phẳng. Các xanthomas củ thường không đau, các nốt sụn thường nằm trên bề mặt khớp.
Bệnh nhân có nồng độ LDL-C cao có thể có cung giác mạc (lắng đọng lipid ở giác mạc xung quanh mống mắt) và ban vàng mí mắt (mảng màu vàng, giàu lipid ở phần giữa mí mắt). Xanthelasma cũng có thể xảy ra ở bệnh nhân xơ gan mật nguyên phát và nồng độ lipid bình thường.
Nồng độ cholesterol toàn phần cực cao khiến huyết tương có màu sữa (màu trắng đục).
Tăng TG nghiêm trọng có thể gây ra u vàng bộc phát trên thân, lưng, khuỷu tay, mông, đầu gối, bàn tay và bàn chân. Tăng triglycerid máu nặng (> 2000 mg/dL [> 22,6 mmol/L]) cũng có thể khiến các động mạch và tĩnh mạch võng mạc xuất hiện màu trắng kem (tăng lipid huyết võng mạc).
Chẩn đoán Rối loạn lipid máu
-
Hồ sơ lipid huyết thanh (đo cholesterol toàn phần, TG và HDL-C và tính LDL-C và VLDL-C)
Rối loạn lipid máu được chẩn đoán bằng cách định lượng lipid huyết thanh. Các chỉ số thường quy (hồ sơ lipid) bao gồm cholesterol toàn phần (TC), TG, HDL-C và LDL-C; những kết quả này được sử dụng để tính LDL-C và VLDL-C.
Rối loạn lipid máu thường được chẩn đoán bằng các xét nghiệm sàng lọc thường quy. Cũng có thể nghi ngờ tình trạng này ở những bệnh nhân có biến chứng rối loạn lipid máu (ví dụ: bệnh xơ vữa động mạch). Các dấu hiệu thực thể ít phổ biến hơn và gợi ý rối loạn lipid máu nguyên phát.
Rối loạn lipid nguyên phát được nghi ngờ khi bệnh nhân có
-
Các dấu hiệu thực thể của rối loạn lipid máu, chẳng hạn như u vàng ở gân, là bệnh lý của tăng cholesterol máu có tính chất gia đình
-
Khởi phát sớm bệnh xơ vữa động mạch (ở độ tuổi < 55 đối với nam giới, < 60 đối với phụ nữ)
-
Tiền sử gia đình mắc bệnh xơ vữa động mạch sớm hoặc tăng lipid máu nặng
-
Cholesterol huyết thanh > 190 mg/dL (> 4,9 mmol/L).
Định lượng hàm lượng lipid
Cholesterol toàn phần (TC), triglyceride (TG) và HDL-C được đo trực tiếp. Giá trị TC và TG phản ánh cholesterol và TG trong tất cả các lipoprotein đang lưu hành, bao gồm chylomicrons, VLDL, lipoprotein tỉ trọng trung bình (IDL), LDL và HDL. Giá trị TC có thể thay đổi 10% và TG lên đến 25% hằng ngày cả khi không có rối loạn.
TC và HDL-C có thể được đo ở trạng thái không nhịn ăn, nhưng hầu hết bệnh nhân cần phải được đo tất cả lipid trong khi nhịn ăn (thường là trong 12 giờ) để có độ chính xác và nhất quán tối đa.
Nên hoãn xét nghiệm nếu bệnh nhân mắc bệnh cấp tính, vì nồng độ TG và lipoprotein(a) tăng và nồng độ cholesterol giảm khi có tình trạng viêm. Ngoài ra, hồ sơ lipid có thể thay đổi trong khoảng 30 ngày sau nhồi máu cơ tim cấp tính (MI); tuy nhiên, kết quả thu được trong vòng 24 tiếng sau khi bị MI thường đủ tin cậy để dẫn hướng điều trị hạ lipid máu ban đầu.
Giá trị LDL-C thường được tính bằng lượng cholesterol không có trong HDL và VLDL. VLDL được TG ước tính ÷ 5 vì nồng độ cholesterol trong các hạt VLDL thường là một phần năm tổng số lipid. Do đó, công thức Friedewald ước lượng LDL-C như sau:
Giá trị cholesterol LDL được tính kết hợp các giá trị đo được của tất cả cholesterol không phải HDL và nonchylomicron, bao gồm cả giá trị trong IDL và lipoprotein (a) (Lp(a)).
Đối với những bệnh nhân có nồng độ TG cao, sai số trong việc ước tính VLDL-C được phóng đại khi sử dụng hệ số không đổi là 5. Phương trình Martin-Hopkins có thể được sử dụng để có được ước tính đáng tin cậy hơn về LDL-C. Hệ số không đổi là 5 được thay thế bằng một hệ số mới dựa trên giá trị TG và non-HDL-C của bệnh nhân (1). Yếu tố mới là yếu tố có thể điều chỉnh được dựa trên nồng độ của Cholesterol không HDL và TG của bệnh nhân và được lấy từ một bảng. Cả hai phương trình Friedewald và Martin-Hopkins đều được phát triển và được xác nhận cho những bệnh nhân nhịn ăn có nồng độ TG huyết thanh < 400 mg/dL (< 4,5 mmol/L).
Phương trình Martin-Hopkins như sau:
LDL-C cũng có thể được đo trực tiếp bằng siêu ly tâm huyết tương, tách chylomicron và các phần VLDL khỏi HDL-C và LDL-C, và bằng phương pháp xét nghiệm miễn dịch. Đo trực tiếp có thể hữu ích ở một số bệnh nhân có TG tăng cao, nhưng các phép đo trực tiếp này thường không cần thiết.
Các xét nghiệm khác
Ở một số bệnh nhân, cần phải làm thêm xét nghiệm lipid máu.
Nồng độ Lp(a) và nồng độ protein phản ứng C cần phải được đo trên bệnh nhân mắc bệnh tim mạch do xơ vữa động mạch sớm, bệnh tim mạch (ngay cả khi họ có nồng độ lipid nguy cơ thấp;
hoặc nồng độ LDL-C cao kháng trị điều trị bằng thuốc. Nồng độ Lp(a) cũng có thể được đo trực tiếp trên bệnh nhân có nồng độ LDL-C cao ở ngưỡng giới hạn để xác định xem có cần điều trị bằng thuốc hay không.
Các giá trị đo được về số lượng hạt LDL hoặc apoprotein B-100 (apo B) rất hữu ích trên bệnh nhân bị tăng TG và có hội chứng chuyển hóa. Apo B cung cấp thông tin tương tự cho số lượng hạt LDL vì có một phân tử apo B cho mỗi hạt LDL. Apo B đo lường bao gồm tất cả các hạt xơ vữa, bao gồm cả tàn dư và Lp (a).
Giá trị Apo B phản ánh tất cả các Cholesteol không HDL (trong VLDL, IDL và LDL) và có tính dự đoán nguy cơ bị CAD nhiều hơn là LDL-C. Cholesterol không HDL (TC−HDL-C) cũng có khả năng dự báo nguy cơ bị bệnh mạch vành cao hơn LDL-C, đặc biệt là trên bệnh nhân tăng triglycerid máu.
Nguyên nhân thứ phát
Các xét nghiệm tìm nguyên nhân thứ phát của rối loạn lipid máu cần phải được thực hiện ở hầu hết các bệnh nhân rối loạn lipid máu mới được chẩn đoán và lặp lại khi một thành phần của cấu trúc lipid thay đổi không rõ nguyên nhân trở nên trầm trọng hơn. Các xét nghiệm này bao gồm
-
Creatinine
-
Đường huyết lúc đói và/hoặc huyết sắc tố glycosyl hóa (HbA1C)
-
Men gan
-
Hormone kích thích tuyến giáp (TSH)
-
Protein niệu
Sàng lọc rối loạn mỡ máu
Việc sàng lọc được thực hiện bằng cách sử dụng hồ sơ lipid lúc đói (TC, TG, HDL-C và LDL-C được tính). Các hướng dẫn của hiệp hội y tế khác nhau về thời điểm bắt đầu sàng lọc. Dựa trên các yếu tố nguy cơ, việc sàng lọc có thể bắt đầu ngay từ 2 tuổi ở trẻ em có tiền sử gia đình mắc bệnh tim hoặc tăng cholesterol máu có tính chất gia đình.
Định lượng lipid nên đi kèm với đánh giá các yếu tố nguy cơ tim mạch khác, bao gồm
-
Sử dụng thuốc lá
-
Tiền sử gia đình bị CAD ở người có quan hệ huyết thống bậc 1 là nam trước 55 tuổi hoặc người có quan hệ huyết thống bậc 1 là nữ trước 65 tuổi
Sàng lọc ở trẻ em
Hầu hết các bác sĩ khuyên nên sàng lọc theo Hướng dẫn của Viện Máu và Tim Phổi Quốc gia 2012 (1) như sau
-
Trẻ em có các yếu tố nguy cơ (ví dụ: bệnh tiểu đường, tăng huyết áp, tiền sử gia đình bị tăng lipid máu nặng hoặc CAD sớm): Thông tin lipid máu khi đói một lần ở tuổi từ 2 đến 8
-
Trẻ em không có các yếu tố nguy cơ: Thông tin lipid không đói hoặc nhịn ăn một lần trước tuổi dậy thì (thường là từ 9 đến 11 tuổi) và một lần nữa ở tuổi 17 đến 21
Sàng lọc ở người lớn
Người lớn cần phải được sàng lọc ở tuổi 20 (2, 3) và 5 năm một lần sau đó.
Độ tuổi ngừng sàng lọc chưa được thiết lập, nhưng bằng chứng ủng hộ việc sàng lọc bệnh nhân ở độ tuổi 80, đặc biệt là nếu họ mắc bệnh tim mạch do xơ vữa động mạch (4).
Bệnh nhân có tiền sử gia đình mắc bệnh tim—nhồi máu cơ tim, đột quỵ hoặc bệnh động mạch vành trước 55 tuổi (ở nam) hoặc 65 tuổi (ở nữ) mà không có các yếu tố nguy cơ đã biết, chẳng hạn như LDL cao, hút thuốc, tiểu đường hoặc béo phì, hoặc tiền sử gia đình đã biết về Lp(a) cao—cũng cần phải được sàng lọc bằng cách đo nồng độ Lp(a).
Điều trị Rối loạn lipid máu
-
Thay đổi lối sống (ví dụ, tập thể dục, chế độ ăn)
-
Đối với LDL-C cao, statin, chất cô lập axit mật, ezetimibe, axit bempedoic và thuốc ức chế PCSK9 (proprotein convertase subtilisin/kexin tuýp 9)
-
Đối với TG cao, niacin, fibrate, axit béo omega-3, và đôi khi các biện pháp khác
Nguyên tắc chung
Mục tiêu chính của điều trị rối loạn lipid máu là phòng ngừa bệnh tim mạch do xơ vữa động mạch (ASCVD), bao gồm hội chứng mạch vành cấp tính, đột quỵ, cơn thiếu máu não cục bộ thoáng qua hoặc bệnh động mạch ngoại biên được cho là do xơ vữa động mạch. Điều trị được chỉ định cho tất cả các bệnh nhân có ASCVD (phòng ngừa thứ phát) và đối với một số bệnh nhân không có (dự phòng ban đầu).
Việc điều trị cho trẻ em đang gây tranh cãi vì không có bằng chứng cho thấy việc hạ thấp nồng độ lipid trong thời thơ ấu có hiệu quả ngăn ngừa bệnh tim ở tuổi trưởng thành. Hơn nữa, độ an toàn và hiệu quả của việc điều trị hạ lipid máu lâu dài ở trẻ em vẫn chưa được biết rõ. Tuy nhiên, Viện Hàn Lâm Nhi khoa Hoa Kỳ (AAP) khuyến nghị điều trị cho một số trẻ em có nồng độ LDL-C tăng. Trẻ em bị tăng cholesterol máu dị hợp tử có tính chất gia đình cần phải được điều trị bắt đầu từ 8 tuổi đến 10 tuổi. Trẻ em bị tăng cholesterol máu đồng hợp tử có tính chất gia đình cần chế độ ăn uống, thuốc men và thường xuyên lọc LDL để ngăn ngừa tử vong sớm; điều trị được bắt đầu khi có chẩn đoán.
Tùy chọn điều trị phụ thuộc vào sự bất thường lipid cụ thể, mặc dù các bất thường lipid khác nhau thường cùng tồn tại. Ở một số bệnh nhân, một bất thường đơn lẻ có thể cần một số liệu pháp; ở những người khác, một điều trị duy nhất có thể là phù hợp với nhiều bất thường. Điều trị phải luôn bao gồm điều trị tăng huyết áp và tiểu đường và cai thuốc lá. Điều trị cũng nên bao gồm aspirin liều thấp hàng ngày trên bệnh nhân từ 40 tuổi đến 79 tuổi có nguy cơ chảy máu thấp và nguy cơ bị nhồi máu cơ tim hoặc tử vong do CAD ≥ 20% trong 10 năm. Nói chung, các lựa chọn điều trị cho nam giới và phụ nữ là như nhau.
Điều trị tăng LDL-C
Đối với tất cả các cá nhân, việc ngăn ngừa ASCVD đòi hỏi phải chú trọng đến lối sống lành mạnh, đặc biệt là chế độ ăn uống và tập thể dục. Các phương án khác để làm giảm LDL-C ở mọi nhóm tuổi bao gồm thuốc, thực phẩm bổ sung và can thiệp bằng thủ thuật. Nhiều trong số những lựa chọn này cũng có hiệu quả để điều trị các rối loạn lipid khác.
Thay đổi chế độ ăn uống giúp duy trì trọng lượng cơ thể lý tưởng và mang lại những lợi ích khác. Những thay đổi này bao gồm
-
Giảm lượng chất béo bão hòa và cholesterol
-
Tăng tỷ lệ chất xơ và carbohydrate phức tạp
Giới thiệu đến một chuyên gia dinh dưỡng thường hữu ích.
Tập thể dục làm giảm LDL-C ở một số người và cũng giúp duy trì trọng lượng cơ thể lý tưởng.
Thay đổi chế độ ăn uống và tập thể dục nên được áp dụng bất cứ khi nào khả thi, nhưng các hướng dẫn của Hiệp hội Tim mạch Hoa Kỳ (AHA)/Đại học Tim mạch Hoa Kỳ (ACC) cũng khuyến nghị sử dụng phương pháp điều trị bằng thuốc cho một số nhóm bệnh nhân nhất định sau khi thảo luận về các nguy cơ và lợi ích của liệu pháp statin (1).
Đối với điều trị bằng thuốc ở người lớn, Hướng dẫn của AHA/ACC khuyến nghị điều trị bằng statin cho 4 nhóm bệnh nhân, bao gồm những người có bất kỳ triệu chứng nào sau đây:
-
ASCVD lâm sàng
-
LDL-C ≥ 190 mg/dL (≥ 4,9 mmol/L)
-
Từ 40 tuổi đến 75 tuổi, mắc bệnh tiểu đường và LDL-C từ 70 mg/dL đến 189 mg/dL (1,8 mmol/L đến 4,9 mmol/L)
-
Từ 40 tuổi đến 75 tuổi, với LDL-C 70 mg/dL đến 189 mg/dL (1,8 mmol/L đến 4,9 mmol/L) và ước tính nguy cơ mắc ASCVD trong 10 năm ≥ 7,5%
Nguy cơ của ASCVD được ước tính bằng cách sử dụng các phương trình đánh giá nguy cơ đoàn hệ gộp. Dụng cụ tính toán nguy cơ này dựa trên giới tính, tuổi tác, chủng tộc, cholesterol toàn phần và HDL-C, huyết áp tâm thu và huyết áp tâm trương, tiểu đường và tình trạng hút thuốc cũng như việc sử dụng thuốc hạ huyết áp hoặc statin.
Tăng nguy cơ suốt đời (được xác định bằng cách sử dụng dụng cụ tính toán nguy cơ AHA/ACC) có liên quan vì nguy cơ 10 năm có thể thấp ở những bệnh nhân trẻ tuổi, những người cần tính đến nguy cơ dài hạn.
Khi cân nhắc việc có nên dùng statin hay không, các bác sĩ lâm sàng cũng có thể tính đến các yếu tố khác, bao gồm
-
LDL-C ≥ 160 mg/dL (4,1 mmol/L)
-
Tiền sử gia đình bị ASCVD sớm (nghĩa là tuổi khởi phát < 55 tuổi ở người có quan hệ huyết thống bậc 1 là nam hoặc < 65 tuổi ở người có quan hệ huyết thống bậc 1 là nữ)
-
Protein phản ứng C có độ nhạy cao ≥ 2 mg/L (≥ 19 nmol/L)
-
Điểm số canxi động mạch vành ≥ 300 đơn vị Agatston (hoặc ≥ 75 phần trăm đối với nhân khẩu học của bệnh nhân)
-
Chỉ số cổ chân – cánh tay < 0,9
-
Tăng nguy cơ suốt đời
Statin là lựa chọn điều trị để làm giảm LDL-C vì bằng chứng đã chứng minh rằng các loại thuốc này làm giảm tỷ lệ mắc bệnh và tỷ lệ tử vong do tim mạch (2). Các nhóm thuốc hạ lipid máu khác không phải là lựa chọn đầu tiên để điều trị tăng LDL-C vì các nhóm đó không chứng minh được hiệu quả tương đương trong việc làm giảm ASCVD.
Statin ức chế hydroxymethylglutaryl CoA reductase, một enzym chủ yếu trong tổng hợp cholesterol, dẫn đến sự điều hòa các receptor LDL và làm tăng độ thanh thải LDL. Các nhóm này làm giảm LDL-C tới 60% và làm tăng HDL-C không đáng kể và làm giảm nhẹ TG. Statin cũng làm giảm tình viêm lớp trong động mạch, viêm hệ thống, hoặc cả hai bằng cách kích thích sản xuất oxit nitric nội mạc và có thể có những tác dụng có lợi khác.
Liệu pháp statin được phân loại là cường độ cao, trung bình hoặc thấp và được đưa ra dựa trên nhóm điều trị và độ tuổi (xem bảng Statin trong phòng ngừa ASCVD). Việc lựa chọn statin phụ thuộc vào bệnh đồng mắc của bệnh nhân, các loại thuốc khác, các yếu tố nguy cơ đối với các biến cố bất lợi, không dung nạp statin, chi phí và sở thích của bệnh nhân.
Tác dụng ngoại ý với statin thường không phổ biến nhưng bao gồm tăng men gan và viêm cơ vân hoặc tiêu cơ vân. Tăng men gan thường không phổ biến, và độc gan nghiêm trọng rất hiếm. Các triệu chứng hoặc tác dụng bất lợi nghiêm trọng liên quan đến cơ xảy ra ở 10% số bệnh nhân dùng statin và có thể phụ thuộc vào liều. Các triệu chứng cơ có thể xảy ra mà không có tăng men cơ (ví dụ: creatine kinase). Tác dụng phụ phổ biến hơn ở bệnh nhân lớn tuổi, bệnh nhân với nhiều bệnh lý và bệnh nhân dùng nhiều loại thuốc. Ở một số bệnh nhân, thay đổi từ một statin sang một loại khác hoặc làm giảm liều (sau khi ngưng thuốc tạm thời) sẽ làm giảm vấn đề này. Độc tính lên cơ dường như là phổ biến nhất khi một số statin được sử dụng với các thuốc ức chế cytochrome P3A4 (ví dụ kháng sinh macrolide, kháng sinh nhóm azole, cyclosporine) và fibrate, đặc biệt là gemfibrozil. Statin là chống chỉ định trong thời kỳ mang thai và cho con bú.
Ở bệnh nhân ASCVD, giảm nguy cơ tăng lên khi giảm nồng độ LDL-C. Do đó, thuốc điều trị ban đầu là statin ở mức liều dung nạp tối đa với mục tiêu làm giảm LDL-C > 50% (điều trị cường độ cao). Đối với những bệnh nhân có nguy cơ rất cao bị ASCVD (ví dụ: những người mới bị nhồi máu cơ tim hoặc đau thắt ngực không ổn định hoặc mắc các bệnh đi kèm có nguy cơ cao như tiểu đường), nồng độ LDL-C > 70 mg/dL (> 1,2 mmol/L) mặc dù điều trị bằng statin tối đa cần phải nhanh chóng bổ sung ezetimibe hoặc thuốc ức chế PCSK9 (ví dụ: evolocumab, alirocumab). Những liệu pháp này đã được chứng minh là làm giảm các biến cố tim mạch nghiêm trọng khi kết hợp với liệu pháp statin trong các thử nghiệm lâm sàng lớn (3, 4).
Các thuốc không phải statin cũng có tác dụng làm giảm LDL-C (xem bảng Thuốc hạ lipid không phải statin). Lộ trình Quyết định Đồng thuận của Chuyên gia ACC năm 2022 về Vai trò của Liệu pháp không dùng statin đưa ra hướng dẫn cho các bác sĩ lâm sàng về vai trò của liệu pháp không dùng statin trong cả phòng ngừa sơ cấp và thứ cấp ASCVD (5). Statin thường là thuốc bước đầu, nhưng trên bệnh nhân không dung nạp statin hoặc những người không thể đạt được nồng độ LDL-C mục tiêu mặc dù sử dụng statin, thuốc không phải statin sẽ được sử dụng.
Thuốc ức chế lyase adenosine triphosphate citrate, axit bempedoic làm suy yếu quá trình tổng hợp cholesterol ở gan và làm tăng các thụ thể LDL. Thuốc này làm giảm LDL-C từ 15% đến 17% (6, 7). Axit bempedoic đặc biệt hữu ích ở những bệnh nhân có tác dụng phụ liên quan đến cơ liên quan đến statin vì nó không gây đau hoặc yếu cơ. Nó có thể được sử dụng dưới dạng đơn trị liệu hoặc như một chất bổ sung cho liệu pháp hạ lipid khác. Các nguy cơ bao gồm tăng acid uric máu và đứt gân.
Các chất cô lập axit mật (cholestyramine, colestipol, colesevelam) ngăn chặn sự tái hấp thu axit mật ở ruột, buộc các thụ thể LDL ở gan phải điều chỉnh tăng để tuyển chọn cholesterol trong hệ tuần hoàn cho quá trình tổng hợp mật. Các chất này đã được chứng minh là làm giảm tỷ lệ tử vong do tim mạch. Chất cô lập axit mật thường được sử dụng cùng với statin hoặc axit nicotinic để tăng cường việc làm giảm LDL-C. Đó là những loại thuốc được lựa chọn cho những phụ nữ đang mang thai hoặc dự định có thai. Statin bị chống chỉ định trong thời kỳ mang thai vì thuốc này có thể gây quái thai do làm gián đoạn quá trình tổng hợp cholesterol cần thiết cho sự phát triển của thai nhi. Thuốc gắn axit mật an toàn, nhưng việc sử dụng chúng bị giới hạn do những tác dụng phụ bao gồm: đầy bụng, buồn nôn, chuột rút và táo bón. Chúng cũng có thể làm tăng TG, do đó việc sử dụng chúng chống chỉ định ở bệnh nhân tăng triglycerid máu. Cholestyramine, colestipol, và colesevelam (nhưng ở mức độ thấp hơn), gây trở ngại vào việc hấp thu các thuốc khác – đặc biệt là thiazides, beta-blockers, warfarin, digoxin và thyroxine – một tác dụng có thể giảm bằng cách dùng ít nhất 4 giờ trước hoặc 1 giờ sau khi dùng thuốc khác. Chất gắn axit mật nên được dùng với ăn để tăng hiệu quả.
Thuốc ức chế hấp thu cholesterol ezetimibe ức chế quá trình hấp thu cholesterol và phytosterol ở ruột. Ezetimibe thường làm giảm LDL-C từ 15% đến 20% và làm tăng nhẹ HDL-C và làm giảm nhẹ triglyceride. Ezetimibe có thể được sử dụng dưới dạng đơn trị liệu trên bệnh nhân không dung nạp statin hoặc thêm vào statin cho bệnh nhân dùng liều statin tối đa bị tăng LDL-C kéo dài. Tác dụng phụ ít gặp.
Các kháng thể đơn dòng PCSK9 (alirocumab, evolocumab) có sẵn dưới dạng tiêm dưới da một hoặc hai lần mỗi tháng. Các thuốc này giữ cho PCSK9 gắn vào các thụ thể LDL, dẫn đến cải thiện chức năng của các thụ thể này. Làm giảm LDL-C từ 40% đến 70%. Các thử nghiệm về kết quả điều trị trên tim mạch với evolocumab và alirocumab cho thấy giảm các biến cố tim mạch trên bệnh nhân mắc bệnh tim mạch xơ vữa động mạch trước đó (3).
SiRNA nhắm mục tiêu PCSK9 được tiêm dưới da 6 tháng một lần. Inclisiran ức chế quá trình sản sinh PCSK9 ở gan, do đó kéo dài hoạt động của các thụ thể LDL và làm giảm nồng độ LDL-C. Mặc dù làm giảm LDL-C, các thử nghiệm về kết quả tim mạch với inclisiran đang được tiến hành. Inclisiran có thể được sử dụng như một chất hỗ trợ cho chế độ ăn kiêng và liệu pháp statin được dung nạp tối đa cho bệnh nhân bị ASCVD hoặc tăng cholesterol máu dị hợp tử có tính chất gia đình.
Thực phẩm chức năng về chế độ ăn uống làm giảm nồng độ LDL-C bao gồm thực phẩm chức năng có chất xơ và bơ thực vật có bán trên thị trường và các sản phẩm khác có chứa sterol thực vật (sitosterol, campesterol) hoặc stanol. Chất bổ sung chất xơ làm giảm mức cholesterol theo nhiều cách, bao gồm giảm hấp thu và tăng bài tiết. Chất bổ sung chất xơ từ yến mạch có thể làm giảm cholesterol toàn phần lên đến 18%. Sterol và stanol thực vật làm giảm sự hấp thu cholesterol bằng cách thay thế cholesterol từ các mixen trong ruột và có thể làm giảm LDL-C tới 10% mà không ảnh hưởng đến HDL-C hoặc TG.
Thuốc ức chế protein chuyển cholesterylester là một nhóm thuốc đang được nghiên cứu và có thể đồng thời làm tăng HDL-C và làm giảm LDL-C. Protein vận chuyển cholesterylester (CETP) là một glycoprotein huyết tương được sản sinh trong gan và trong mô mỡ lưu, thông trong máu gắn kết chủ yếu với HDL, làm trung gian vận chuyển este cholesteryl từ HDL sang các hạt chứa ApoB.
Thuốc điều trị tăng cholesterol máu đồng hợp tử có tính chất gia đình
Thuốc điều trị tăng cholesterol máu đồng hợp tử có tính chất gia đình bao gồm thuốc ức chế PCSK9, lomitapide và evinacumab. Lomitapide là một chất ức chế protein chuyển triglycerid ở microsom thể gây cản trở việc bài tiết lipoprotein giàu TG ở gan và ruột. Liều khởi đầu thấp và tăng dần mỗi 2 tuần. Bệnh nhân phải tuân theo chế độ ăn với ít hơn 20% lượng calo từ chất béo. Lomitapide có thể gây ra các tác dụng phụ trên đường tiêu hóa (như tiêu chảy, gan nhiễm mỡ, tăng men gan). Evinacumab là một kháng thể đơn dòng tái tổ hợp của người liên kết và ức chế protein 3 giống angiopoietin, một chất ức chế LPL và lipase nội mô. Thuốc có thể làm giảm LDL-C (47%), TG và HDL-C. Evinacumab được tiêm truyền tĩnh mạch mỗi tháng một lần. Nó có thể gây ra bệnh gút, bệnh giống cúm và các phản ứng truyền dịch.
Phương pháp tiếp cận bằng thủ thuật
Các phương pháp tiếp cận bằng thủ thuật được dành riêng cho những bệnh nhân bị tăng lipid máu nặng (LDL-C > 300 mg/dL [> 7,74 mmol/L]) và không có bệnh mạch máu. Lọc LDL có thể được thực hiện trên bệnh nhân có LDL-C > 200 mg/dL (> 5,16 mmol/L) và bệnh mạch máu khó điều trị với liệu pháp thông thường, chẳng hạn như xảy ra với tăng cholesterol máu có tính chất gia đình. Các lựa chọn bao gồm lọc LDL huyết tương (trong đó LDL được loại bỏ bằng trao đổi huyết tương ngoài cơ thể) và, hiếm khi, bypass hồi tràng (để ngăn chặn sự hấp thụ lại axit mật) và ghép gan (cấy ghép các thụ thể LDL. Lọc LDL là thủ thuật được lựa chọn trong hầu hết các trường hợp khi liệu pháp dung nạp tối đa không làm giảm LDL-C một cách thỏa đáng. Lọc huyết tương cũng là phương pháp điều trị thông thường ở những bệnh nhân có tình trạng tăng cholesterol máu tính chât gia đình, đáp ứng hạn chế điều trị bằng thuốc hoặc không đáp ứng.
Tăng LDL-C ở trẻ em
Các yếu tố nguy cơ ở trẻ em bên cạnh tiền sử gia đình và bệnh tiểu đường bao gồm hút thuốc lá, tăng huyết áp, HDL-C thấp (< 35 mg/dL [< 0,9 mmol/L]), béo phì và lười vận động.
Hiệp hội Tim mạch Hoa Kỳ khuyến nghị điều trị bằng chế độ ăn cho trẻ em có LDL-C > 110 mg/dL (> 2,8 mmol/L) (8).
Liệu pháp dùng thuốc được khuyến cáo cho trẻ em > 8 tuổi và với một trong những điều sau đây:
-
Đáp ứng kém với liệu pháp ăn kiêng, LDL-C ≥ 190 mg/dL (≥ 4,9 mmol/L) và không có tiền sử gia đình bị bệnh tim mạch sớm
-
LDL-C ≥ 160 mg/dL (≥ 4.13 mmol/L) và tiền sử gia đình bị bệnh tim mạch sớm hoặc ≥ 2 yếu tố nguy cơ mắc bệnh tim mạch sớm
Các loại thuốc được sử dụng ở trẻ em bao gồm nhiều loại statin. Trẻ em bị tăng cholesterol máu có tính chất gia đình có thể cần dùng thuốc thứ hai để đạt được mức giảm LDL-C ít nhất 50%.
Tăng triglyceride
Mặc dù không rõ liệu tăng TG có góp phần độc lập vào bệnh tim mạch hay không, nhưng chất này có liên quan đến nhiều bất thường về chuyển hóa góp phần gây ra bệnh động mạch vành (ví dụ: bệnh tiểu đường, hội chứng chuyển hóa). Các đồng thuận đang làm rõ rằng giảm tình trạng TG tăng là có lợi. Không có mục tiêu xác định, nhưng nồng độ < 150 mg/dL (< 1,7 mmol/L) thường được coi là mong muốn. Không có hướng dẫn cụ thể đối với việc điều trị tăng TG ở trẻ em.
Các chiến lược điều trị tổng thể là thực hiện thay đổi lối sống trước tiên, bao gồm tập thể dục, giảm cân, tránh ăn uống thực phẩm chứa đường và rượu. Ăn từ 2 đến 4 phần ăn/tuần cá biển có hàm lượng axit béo omega-3 cao có thể có hiệu quả, nhưng lượng axit béo omega-3 thường thấp hơn mức cần thiết; bổ sung có thể hữu ích. Ở bệnh nhân đái tháo đường, nồng độ glucose cần được kiểm soát chặt chẽ. Nếu các biện pháp này không có hiệu quả, nên giảm các thuốc giảm lipid. Bệnh nhân có nồng độ TG rất cao (> 1.000 mg/dL [> 11 mmol/L]) cần phải bắt đầu điều trị bằng thuốc tại thời điểm chẩn đoán để nhanh chóng giảm nguy cơ viêm tụy cấp.
Fibrate giảm TG khoảng 50%. Chúng kích thích lipoprotein lipase (LPL) nội mô, dẫn đến tăng oxy hóa axit béo trong gan và cơ và giảm sự tổng hợp VLDL ở gan. Thuốc cũng làm tăng HDL-C lên tới 20%. Fibrat có thể gây ra các tác dụng phụ trên đường tiêu hóa, bao gồm chứng khó tiêu, đau bụng, và tăng men gan. Thuốc này hiếm gặp gây sỏi mật. Fibrat có thể làm tăng độc tính tới cơ khi dùng với statin và làm tăng tác dụng của warfarin.
Statin có thể được sử dụng ở bệnh nhân có TG < 500 mg/dL (< 5,65 mmol/L) nếu cũng có tăng LDL-C; statin có thể làm giảm LDL-C và TG thông qua việc làm giảm VLDL. Nếu chỉ TG được nâng cao, fibrate là thuốc được lựa chọn.
Axit béo omega-3 với liều cao (1-6 g/ngày của axit eicosapentaenoic [EPA] và docosahexaenoic acid [DHA]) có thể có hiệu quả trong việc làm giảm TG. Các axit béo omega-3 EPA và DHA là thành phần hoạt tính trong dầu cá biển hoặc viên nang omega-3. Tác dụng ngoại ý bao gồm eructation và tiêu chảy. Có thể làm giảm các tác dụng này bằng cách cho dùng viên nang dầu cá với bữa ăn theo các liều phân chia (ví dụ: 2 hoặc 3 lần/ngày). Axit béo omega-3 có thể là một thuốc bổ sung hữu ích cho các liệu pháp khác. Các chế phẩm axit béo omega-3 theo đơn được chỉ định cho nồng độ TG > 500 mg/dL ((> 5.65 mmol/L).
Thuốc ức chế Apo CIII (một chất ức chế antisense của apo CIII), volanesorsen, có sẵn ở một số quốc gia. Thuốc làm giảm nồng độ triglyceride ở những bệnh nhân có nồng độ TG tăng cao, bao gồm cả những người bị thiếu hụt lipase lipoprotein. Nó được tiêm dưới dạng hàng tuần.
HDL-C thấp
Mặc dù nồng độ HDL-C cao hơn dự đoán nguy cơ tim mạch thấp hơn, nhưng vẫn chưa rõ liệu các phương pháp điều trị làm tăng nồng độ HDL-C có làm giảm nguy cơ tử vong hay không. Hướng dẫn trong Báo cáo thứ ba của Hội đồng chuyên gia NCEP xác định HDL-C thấp là < 40 mg/dL [< 1.04 mmol/L]; các hướng dẫn không chỉ định nồng độ mục tiêu của HDL-C và khuyến nghị các biện pháp can thiệp để làm tăng HDL-C chỉ sau khi đạt được các mục tiêu LDL-C (9). Các phương pháp điều trị làm giảm LDL-C và TG thường làm tăng HDL-C và đôi khi có thể đạt được đồng thời cả 3 mục tiêu.
Không có hướng dẫn cụ thể nào đề cập đến việc điều trị HDL-C thấp ở trẻ em.
Điều trị bao gồm thay đổi lối sống như tăng tập thể dục và giảm cân. Rượu làm tăng HDL-C nhưng không được khuyến nghị thường xuyên là một liệu pháp vì nhiều tác dụng phụ khác của nó. Thuốc có thể thành công trong việc nâng cao nồng độ khi chỉ thay đổi lối sống là không đủ, nhưng không chắc liệu việc tăng nồng độ HDL-C có làm giảm tỷ lệ tử vong hay không.
Axit nicotinic (niacin) là thuốc hiệu quả nhất trong việc làm tăng HDL-C. Vẫn chưa biết cơ chế tác dụng của thuốc, nhưng dường như thuốc vừa làm tăng sản sinh HDL-C vừa ức chế thanh thải HDL-C; thuốc cũng có thể huy động cholesterol từ đại thực bào. Niacin cũng làm giảm TG và với liều từ 1500 mg đến 2000 mg mỗi ngày sẽ làm giảm LDL-C. Niacin gây đỏ bừng mặt, ngứa và buồn nôn; dùng aspirin liều thấp có thể ngăn ngừa những tác dụng phụ này. Các chế phẩm phóng thích kéo dài thường ít gây cơn bừng mặt. Tuy nhiên, hầu hết các chế phẩm không kê đơn phóng thích chậm không được khuyến cáo; ngoại lệ là polygel niacin phóng thích có kiểm soát. Niacin có thể gây tăng men gan và đôi khi suy gan, kháng insulin, tăng acid uric máu và gout. Nó cũng có thể làm tăng nồng độ homocysteine. Kết hợp niacin liều cao với statin có thể làm tăng nguy cơ bệnh cơ. Trên bệnh nhân có nồng độ LDL-C trung bình và HDL-C dưới mức trung bình, niacin phối hợp với điều trị bằng statin có thể có hiệu quả trong việc ngăn ngừa rối loạn tim mạch. Trên những bệnh nhân được điều trị bằng statin để làm giảm LDL-C xuống < 70 mg/dL (< 1,8 mmol/L), niacin dường như không có thêm lợi ích và có thể làm tăng tác dụng bất lợi, bao gồm đột quỵ do thiếu máu não cục bộ.
Fibrate làm tăng HDL-C. Fibrate có thể làm giảm nguy cơ tim mạch trên những bệnh nhân có TG > 200 mg/dL (> 2,26 mmol/L) và HDL-C < 40 mg/dL (< 1,04 mmol/L).
Tăng Lp (a)
Phương pháp tiếp cận thông thường trên bệnh nhân tăng Lp(a) là làm giảm mạnh LDL-C. Lọc LDL huyết tương đã được sử dụng để giảm Lp (a) ở những bệnh nhân có mức Lp (a) cao và bệnh mạch máu tiến triển.
Giới hạn trên của giá trị bình thường đối với Lp(a) là khoảng 30 mg/dL (75 nmol/L), nhưng giá trị ở người Mỹ gốc Phi có xu hướng cao hơn. Có vài dữ liệu để hướng dẫn điều trị tăng Lp (a) hoặc để xác định hiệu quả điều trị. Niacin là thuốc duy nhất trực tiếp làm giảm Lp (a); thuốc có thể làm giảm Lp (a) > 20% ở liều cao hơn. Có một số liệu pháp dựa trên RNA làm giảm nồng độ Lp(a) trong quá trình phát triển lâm sàng.
Điều trị bệnh nhân có bệnh kèm theo
Điều trị rối loạn lipid máu do đái tháo đường cần phải luôn bao gồm thay đổi lối sống và dùng statin để làm giảm LDL-C. Để làm giảm nguy cơ viêm tụy, fibrate có thể được sử dụng để làm giảm TG khi nồng độ > 500 mg/dL (> 5,65 mmol/L). Metformin làm giảm TG, có thể là một lý do để lựa chọn thuốc hơn so với các loại thuốc uống hạ đường huyết khác khi điều trị đái tháo đường. Một số thiazolidinediones (TZDs) làm tăng cả HDL-C và LDL-C. Một số TZD cũng làm giảm TG. Những thuốc hạ đường huyết này không nên lựa chọn với thuốc hạ lipid để điều trị bệnh nhân đái tháo đường có rối loạn lipid máu nhưng có thể là thuốc bổ sung. Bệnh nhân có nồng độ TG rất cao và kiểm soát đường huyết kém có thể đáp ứng tốt hơn với insulin so với thuốc uống hạ đường huyết.
Điều trị rối loạn lipid máu ở những bệnh nhân bị suy giáp, bệnh thận mạn tính, bệnh gan hoặc kết hợp các rối loạn này bao gồm điều trị các rối loạn cơ bản và các bất thường lipid thứ phát. Mức lipid bất thường ở những bệnh nhân có chức năng tuyến giáp giới hạn thấp (nồng độ TSH bình thường cao) sẽ cải thiện khi điều trị hormone thay thế. Giảm liều hoặc ngừng thuốc gây rối loạn lipid cần được cân nhắc.
Theo dõi điều trị
Nồng độ lipid cần được theo dõi định kỳ sau khi bắt đầu điều trị. Không có dữ liệu xác định khoảng thời gian theo dõi cụ thể, nhưng định lượng nồng độ lipid từ 2 đến 3 tháng sau khi bắt đầu hoặc thay đổi phương pháp điều trị và một hoặc hai lần mỗi năm sau khi mức lipid ổn định là thực hành chung.
Nhiễm độc gan và cơ nghiêm trọng khi sử dụng statin xảy ra ở 0,5 đến 2% tổng số người dùng. Việc theo dõi thường xuyên nồng độ men gan là không cần thiết và việc đo creatine kinase (CK) thường quy không hữu ích để dự đoán sự khởi phát của tiêu cơ vân. Nồng độ men cơ không cần phải được kiểm tra thường xuyên trừ khi bệnh nhân bị đau cơ hoặc các triệu chứng cơ khác. Nếu nghi ngờ statin gây tổn thương cơ, ngừng sử dụng statin và định lượng CK. Khi các triệu chứng cơ giảm, liều thấp hơn hoặc thuốc statin khác có thể điều trị thử. Nếu các triệu chứng không giảm trong vòng 1 đến 2 tuần sau khi ngừng statin, cần tìm ra nguyên nhân khác cho các triệu chứng cơ (ví dụ đau đa cơ khớp dạng thấp).